| Thí nghiệm | Cách tiến hành | Hiện tượng - PTHH | Kết luận |
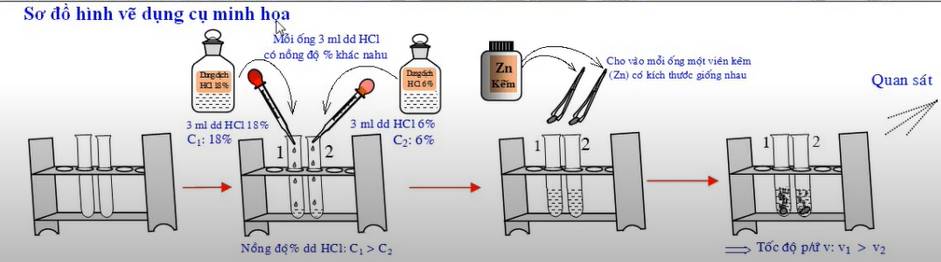
Ảnh hưởng của nồng độ đến tốc độ phản ứng | Chuẩn bị hai ống nghiệm, ống thứ nhất chứa 3ml dung dịch HCl nồng độ 18%, ống thứ hai chứa 3ml dung dịch HCl nồng độ 6%. Cho đồng thời vào mỗi ống một hạt kẽm có kích thước giống nhau | Trong ống nghiệm thứ nhất viên kẽm tan nhanh hơn và có nhiều bọt khí thoát ra khỏi dung dịch hơn so với ống nghiệm thứ hai. Zn + 2HCl → ZnCl2 + H2 | Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng. |
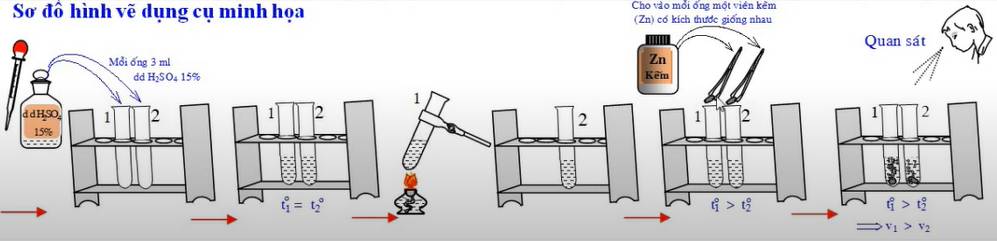
Ảnh hưởng của nhiệt độ đến tốc độ phản ứng | Chuẩn bị hai ống nghiệm, mỗi ống đựng 3ml dung dịch H2SO4 nồng độ khoảng 15%. Đun dung dịch trong một ống đến gần sôi, ống còn lại để nguyên rồi cho đồng thời vào mỗi ống một hạt Zn có kích thước giống nhau. | Viên kẽm trong ống nghiệm bị đun nóng tan nhanh hơn, khí thoát ra ở ống nghiệm bị đun nóng cũng nhiều hơn so với ống nghiệm không bị đun. Zn + 2H2SO4 → ZnSO4 + H2 | Khi tăng nhiệt độ, tốc độ phản ứng tăng. |
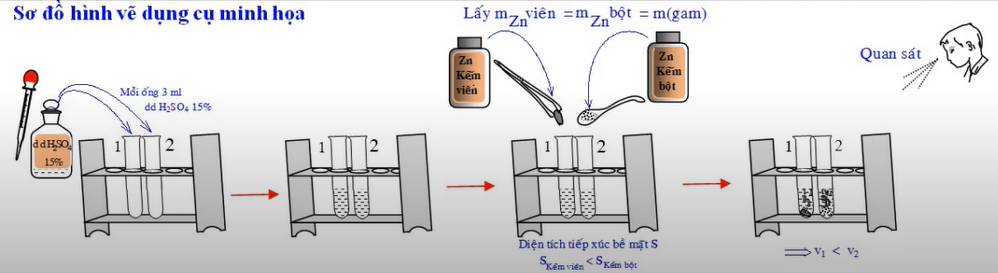
Ảnh hưởng của diện tích tiếp xúc đến tốc độ phản ứng | Chuẩn bị hai ống nghiệm, mỗi ống đựng 3ml dung dịch H2SO4 nồng độ khoảng 15%, sau đó chuẩn bị hai mẩu Zn có khối lượng bằng nhau. Một mẩu có kích thước hạt nhỏ hơn mẩu còn lại. Cho đồng thời hai mẩu Zn vào dung dịch H2SO4 ở trên. | Ống nghiệm được cho vào mẩu Zn có kích thước hạt nhỏ hơn (kẽm bột) xảy ra phản ứng nhanh hơn, có nhiều khí thoát ra hơn và lượng Zn tan nhanh hơn so với ống nghiệm được thêm vào mẩu Zn kích thước lớn (kẽm hạt). Zn + 2H2SO4 → ZnSO4 + H2 | Khi tăng diện tích tiếp xúc của chất phản ứng, tốc độ phản ứng tăng. |
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!