- Sulfuric acid có công thức phân tử là H2SO4 với cấu tạo như sau:
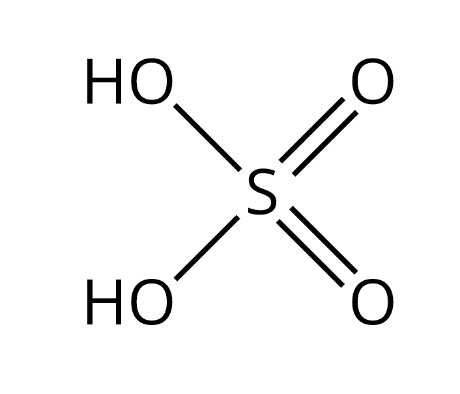
- Sulfuric acid là chất lỏng sánh như dầu, không màu, không bay hơi. Dung dịch sulfuric acid đặc có khả năng hút ẩm nên thường để dùng làm khô hóa chất trong các bình hút ẩm.
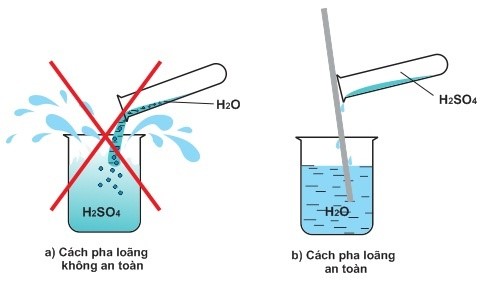
- Sulfuric acid tan tốt trong nước. Quá trình hòa tan tỏa nhiệt lớn. Vì vậy, để đảm bảo an toàn khi pha loãng dung dịch sulfuric acid đặc, phải cho từ từ acid đặc vào nước, không được cho nước và acid.
Dung dịch sulfuric acid loãng có các tính chất chung của acid:
- Đổi màu quỳ tím thành đỏ.
- Tác dụng với kim loại hoạt động trong dãy hoạt động hóa học.
- Tác dụng với basic oxide và base.
- Tác dụng với nhiều muối.
Ngoài tính acid mạnh, dung dịch sulfuric acid đặc còn có các tính chất hóa học đặc trưng sau:
- Tính oxi hóa mạnh
Dung dịch sulfuric acid đặc có tính oxi hóa rất mạnh, oxi hóa được hầu hết các kim loại (trừ vàng, platinium), nhiều phi kim như carbon, sulfur, phosphorus,... và nhiều hợp chất.
Ví dụ:
2H2SO4 + Cu \(\rightarrow\) CuSO4 + SO2 + 2H2O
2H2SO4 + S \(\rightarrow\) 3SO2 + 2H2O
2H2SO4 + 2KBr \(\rightarrow\) K2SO4 + Br2 + SO2 + 2H2O
- Tính háo nước
Dung dịch sulfuric acid đặc hấp thụ mạnh nước. Nó có khả năng chiếm nước của nhiều hợp chất hoặc chiếm các nguyên tố O và H (thành phần của nước) trong nhiều hợp chất.
Ví dụ: nhỏ dung dịch H2SO4 đặc vào các hợp chất có dạng Cn(H2O)m (như đường saccharose, glucose, tinh bột,...), sẽ có các phản ứng sau:
Cn(H2O)m \(\overset{H_{2}SO_{4}\ đặc}{\rightarrow}\) nC + mH2O
C + H2SO4 \(\rightarrow\) CO2 + 2SO2 + 2H2O
\(\Rightarrow\) Các hợp chất dạng Cn(H2O)m bị than hóa do phản ứng tạo ra carbon. Một phần carbon sẽ tiếp tục bị oxi hóa bởi acid tạo thành khí.
Khi bị dính dung dịch sulfuric acid đặc, cơ thể người sẽ bị tổn thương nặng do tế bào bị mất nước, bị đốt nóng từ lượng nhiệt phát ra và bị oxi hóa mạnh. Vì vậy, phải hết sức thận trọng khi sử dụng dung dịch sulfuric acid đặc.
Trong phòng thí nghiệm, các chai, lọ chứa sulfuric acid phải được bảo quản ở nơi ít có nguy cơ bị va chạm, xa nguồn nhiệt và các hóa chất khác. Khi làm việc với sulfuric acid, cần sử dụng các dụng cụ bảo hộ như áo bảo hộ, kính bảo hộ, găng tay chống thấm,...
Khi bị bỏng bởi dung dịch sulfuric acid, cần sơ cứu người bị bỏng bằng cách rửa sạch vết bỏn dưới vòi nước sạch trong ít nhất 20 phút để rửa trôi acid đồng thời làm giảm nhiệt phát ra từ quá trình oxi hóa trước khi đưa đến cơ sở y tế. Việc rửa bằng nước sạch có thể tiến hành tiếp tục trong lúc di chuyển nạn nhân.
Bỏng sulfuric acid có thể dẫn tới nhiễm trùng máu nếu xử lí không đúng trong bước sơ cứu. Vì vậy, chỉ nên dùng nước sạch để sơ cứu. Tuyệt đối không chườm đá lạnh, không xoa vết bỏng bằng kém, gel, dầu,...
- Nguyên liệu: khoáng vật sulfur (thành phần chính là S) hoặc khoáng vật pyrite (thành phần chính là FeS2).
- Quá trình sản xuất sulfuric acid trải qua ba giai đoạn.
+ Giai đoạn 1: Sản xuất sulfur dioxide
Tùy thuộc vào nguồn nguyên liệu, sulfur dioxide được sản xuất bằng cách đốt cháy sulfur, pyrite hoặc quặng sulfide trong lò đốt bằng không khí.
S (s) + O2 (g) \(\overset{t{^\circ}}{\rightarrow}\) SO2 (g)
4FeS2 (s) + 11O2 (g) \(\overset{t{^\circ}}{\rightarrow}\) 2Fe2O3 (s) + 8SO2 (g)
- Giai đoạn 2: Sản xuất sulfur trioxide
Oxi hóa sulfur dioxide bằng không khí dư ở nhiệt độ khoảng 450oC, áp suất 1 – 2 bar, xúc tác vanadium (V) oxide (V2O5), hiệu suất đạt trên 98%:
2SO2 (g) + O2 (g) \(\rightleftharpoons\) 2SO3 (g) \(\mathrm{\Delta}H_{298}^{o} = - 197,6\ kJ\)
- Giai đoạn 3: Hấp thụ sulfur trioxide bằng sulfuric acid 98%, tạo ra oleum (hỗn hợp các acid có công thức chung dạng H2SO4.nSO3). Sau đó pha loãng oleum vào nước thu được dung dịch sulfuric acid loãng.
H2SO4 + nSO3 \(\rightarrow\) H2SO4.nSO3
Từ oleum, có thể pha thành dung dịch sulfuric acid có nồng độ theo nhu cầu.
H2SO4.nSO3 + H2O \(\rightarrow\) (n+1)H2SO4
- Muối sulfate là hợp chất có chứa ion sulfate (SO42-). Đa số các muối sulfate tan trong nước, calcium sulfate rất ít tan, barium sulfate được coi là không tan trong nước.
- Các muối sulfate có nhiều ứng dụng trong cuộc sống.
Để nhận biết sự có mặt của ion sulfate (SO42-) trong dung dịch, người ta sử dụng dung dịch muối của Ba2+, tạo ra kết tủa trắng barium sulfate (BaSO4) không tan trong các dung dịch acid và base, theo phương trình ion thu gọn:
Ba2+ + SO42- \(\rightarrow\) BaSO4
1. Dung dịch sulfuric acid loãng có các tính chất chung của acid.
2. Dung dịch sulfuric acid đặc có tính háo nước và tính oxi hóa mạnh.
3. Dung dịch sulfuric acid được sản xuất từ nguyên liệu là khoáng vật sulfur hoặc pyrite theo phương pháp tiếp xúc.
4. Các muối sulfate có nhiều ứng dụng trong thực tế.
5. Ion SO42- thường được nhận biết nhờ phản ứng với ion Ba2+ tạo kết quả trắng.