- Sulfur có kí hiệu hóa học là S, số hiệu nguyên tử là 16, độ âm điện là 2,58.
- Trong tự nhiên, sulfur tồn tại ở cả dạng đơn chất và hợp chất.
+ Đơn chất sulfur được tìm thấy chủ yếu tại các vùng có núi lửa, nhiều nhất ở các nước thuộc vành đai lửa Thái Bình Dương như Nhật Bản, Chile, Indonesia,...

+ Phần lớn sulfur tồn tại ở dạng hợp chất trong các thành phần của các khoáng vật, như pyrite (thành phần chính là FeS), sphalerite (thành phần chính là ZnS), thạch cao (thành phần chính là CaSO4), barite (thành phần chính là BaSO4),...

+ Ngoài ra sulfur còn có trong thành phần của một số protein động vật, thực vật.
Ở điều kiện thường, đơn chất sulfur là chất rắn, có màu vàng, không tan trong nước, tan ít trong ethanol, tan nhiều trong dầu hỏa, benzene. Sulfur nóng chảy ở khoảng 113oC, hóa hơi ở khoảng 445oC.
Ở điều kiện thường, phân tử đơn chất sulfur gồm 8 nguyên tử S (S8).
Để đơn giản, người ta dùng kí hiệu S mà không dùng công thức phân tử S8 trong các phản ứng hóa học. Khi tham gia phản ứng hóa học, sulfur thể hiện tính oxi hóa hoặc tính khử.
- Tính oxi hóa: sulfur phản ứng với kim loại, hydrogen tạo ra các hợp chất sulfide.
Ví dụ:
+ Sulfur phản ứng với bột săt ở nhiệt độ cao:
S (s) + Fe (s) \(\overset{t{^\circ}}{\rightarrow}\) FeS (s)
+ Sulfur phản ứng với thủy ngân (mercury) ngay ở nhiệt độ thường
S (s) + Hg (l) \(\rightarrow\) HgS (s)
\(\Rightarrow\) Xử lí thủy ngân rơi vãi khi nhiệt kế thủy ngân bị vỡ, hạn chế tác động của thủy ngân đến sức khỏe.
- Tính khử: ở nhiệt độ thích hợp, sulfur phản ứng với một số phi kim như oxygen, chlorine, fluorine.
Ví dụ: phản ứng đốt nóng sulfur trong không khí:
S (s) + O2 (g) \(\overset{t{^\circ}}{\rightarrow}\) SO2 (g) \(\mathrm{\Delta}H_{298}^{o} = - 296,8\ kJ\)
- Ở điều kiện thường, sulfur dioxide (SO2) là chất khí không màu, có mùi hắc, độc, tan nhiều trong nước.
- Sulfur dioxide thể hiện tính chất của acidic oxide như phản ứng với nước tạo môi trường acid, phản ứng với basic oxide hoặc base tạo thành muối.
- Sulfur dioxide thể hiện cả tính oxi hóa và tính khử.
Ví dụ:
+ Sulfur dioxide oxi hóa hydrogen sulfide (H2S) để tạo ra bột sulfur màu vàng.
SO2 (g) + 2H2S (g) \(\rightarrow\) 3S (s) + 2H2O (l)
+ Sulfur dioxide phản ứng với oxygen (xúc tác NO hoặc NO2) trong quá trình hình thành mưa acid.
2SO2 (g) + O2 (g) \(\overset{xt}{\rightarrow}\) 2SO3 (g)
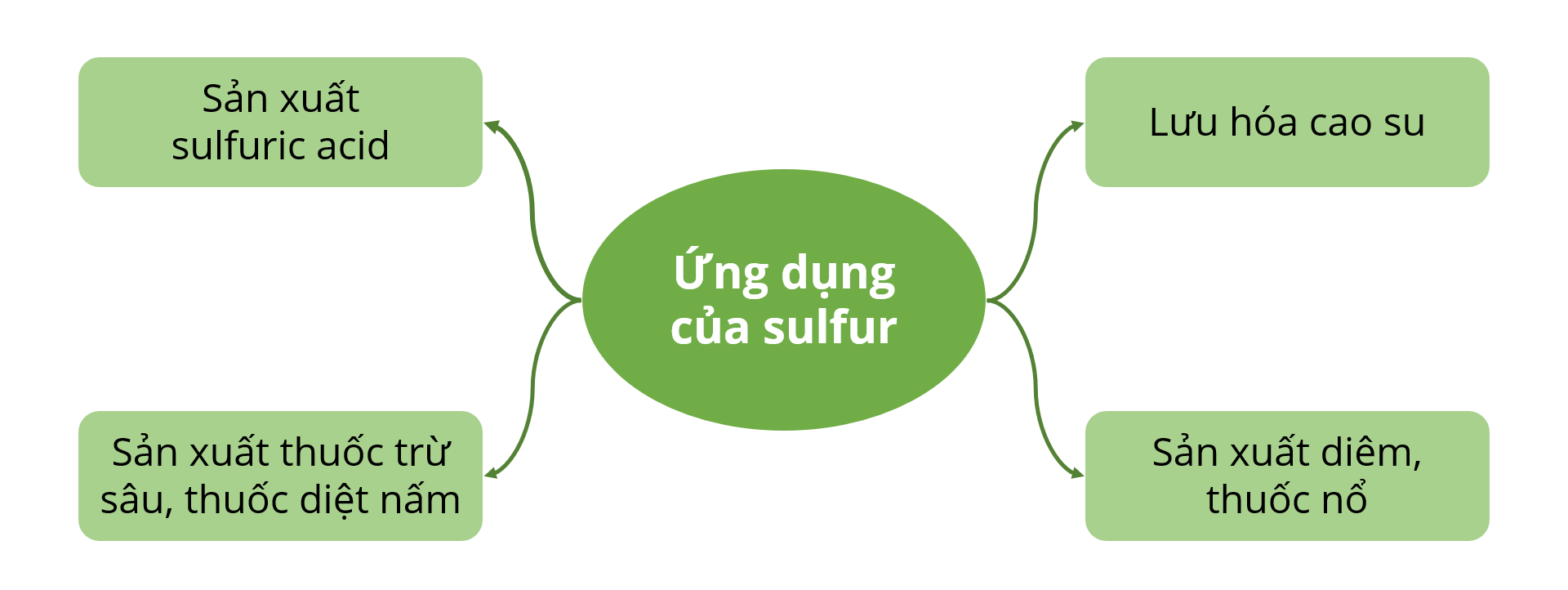
- Chất trung gian quan trọng trong quá trình sản xuất sulfuric acid.
- Tẩy trắng vải sợi, đường.
- Sản xuất thuốc trừ sâu, thuốc sát trùng.
- Sử dụng trong công nghệ thực phẩm để hạn chế sự phát triển của vi sinh vật.
- Khí sulfur dioxide sinh ra từ quá trình đốt cháy sulfur được dùng để diệt khuẩn và nấm mốc hay bảo quản hoa quả sấy khô, dược liệu từ thực vật. Tuy nhiên hiện nay, biện pháp bảo quản này đã bị cấm sử dụng do gây nhiễm độc thực phẩm.
- Nguồn phát thải sulfur dioxide vào khí quyển:
+ Hoạt động của núi lửa.
+ Hoạt động đốt cháy nhiên liệu của con người.
+ Quá trình sản xuất sulfuric acid.
- Ảnh hưởng của khí sulfur dioxide
+ Nguyên nhân gây mưa acid.
+ Ảnh hưởng đến sức khỏe con người: tạo cảm giác khó thở, gây bệnh viêm đường hô hấp, đau mắt. Khi vào cơ thể, khí này kết hợp với nước tạo ra acid, làm giảm pH của máu gây rối loạn nhiều quá trình chuyển hóa trong cơ thể, làm giảm khả năng vận chuyển oxygen của hồng cầu.
- Biện pháp giảm thải sulfur dioxide vào khí quyển
+ Thay thế dần các nhiên liệu hóa thạch bằng nhiên liệu thân thiện với môi trường như ethanol, hydrogen,... kết hợp với khai thác các nguồn năng lượng tái tạo như năng lượng mặt trời, năng lượng gió.
+ Xử lí khí thải của các nhà máy trước khi thải ra môi trường như dẫn vào tháp hoặc bồn các chất hấp phụ phù hợp, hấp phụ sulfur dioxide.
+ Chuyển hóa sulfur dioxide thành các chất ít gây ô nhiễm hơn bằng các hóa chất như vôi sống (CaO), vôi tôi (Ca(OH)2) hoặc đá vôi nghiền (CaCO3).
1. Trong tự nhiên, sulfur tồn tại ở cả dạng đơn chất và hợp chất.
2. Sulfur (S8) có tính khử và tính oxi hóa. Sulfur là nguyên liệu để sản xuất sulfuric acid, dược phẩm, thuốc trừ sâu,...
3. Sulfur dioxide (SO2) có tính khử và tính oxi hóa. SO2 thường được dùng để sản xuất sulfuric acid, tẩy trắng vải sợi,... Tuy nhiên, sự có mặt của SO2 trong không khí gây ô nhiễm môi trường, ảnh hưởng sức khỏe. Vì vậy cần phải hạn chế sự phát thải của khí SO2 ra môi trường.