- Sulfur là nguyên tố phổ biến thứ 17 trên vỏ Trái Đất, chiễm khoảng 0,03 – 0,1% khối lượng, tồn tại ở bốn dạng đồng vị bền: 32S (94,98%), 33S (0,76%), 34S (4,22%) và 36S (0,02%).
- Trong tự nhiên, sulfur tồn tại ở cả dạng đơn chất và dạng hợp chất. Đơn chất sulfur được phân bố ở dùng lân cận núi lửa và suối nước nóng,... Hợp chất sulfur gồm các khoáng vật sulfide, sulfate, protein,...


- Sulfur được giải phóng ra khỏi lõi Trái Đất chủ yếu dưới dạng sulfur dioxide (SO2) và hydrogen sulfide (H2S) khi núi lửa hoạt động. Sau đó, hydrogen sulfide chuyển hóa thành muối sulfide ít tan (tạo thành các khoáng vật pyrite, chalcopyrite,...) và sulfur dioxide chuyển hóa thành muối sulfate của calcium, barium (tạo thành các khoáng vật như thạch cao).
- Trong cơ thể người, sulfur chiếm khoảng 0,2% khối lượng, có trong thành phần nhiều protein và enzyme.
- Nguyên tố sulfur ở ô số 16, chu kì 3, nhóm VIA trong bảng tuần hoàn. Nguyên tử sulfur có độ âm điện là 2,58. Sulfur có tính phi kim.
- Sulfur tạo ra nhiều hợp chất với các số oxi hóa khác nhau từ -2 đến +6, ví dụ: H2S, SO2, SO3,...
Phân tử sulfur gồm 8 nguyên tử (S8) có dạng vòng khép kín. Mỗi nguyên tử sulfur liên kết với hai nguyên tử bên cạnh bằng hai liên kết cộng hóa trị không phân cực. Liên kết S – S có năng lượng liên kết bằng 226 kJ/mol và có độ dài liên kết là 205 pm.
.png)
- Đơn chất sulfur có hai dạng thù hình: dạng tà phương (bền ở nhiệt độ thường) và dạng đơn tà.
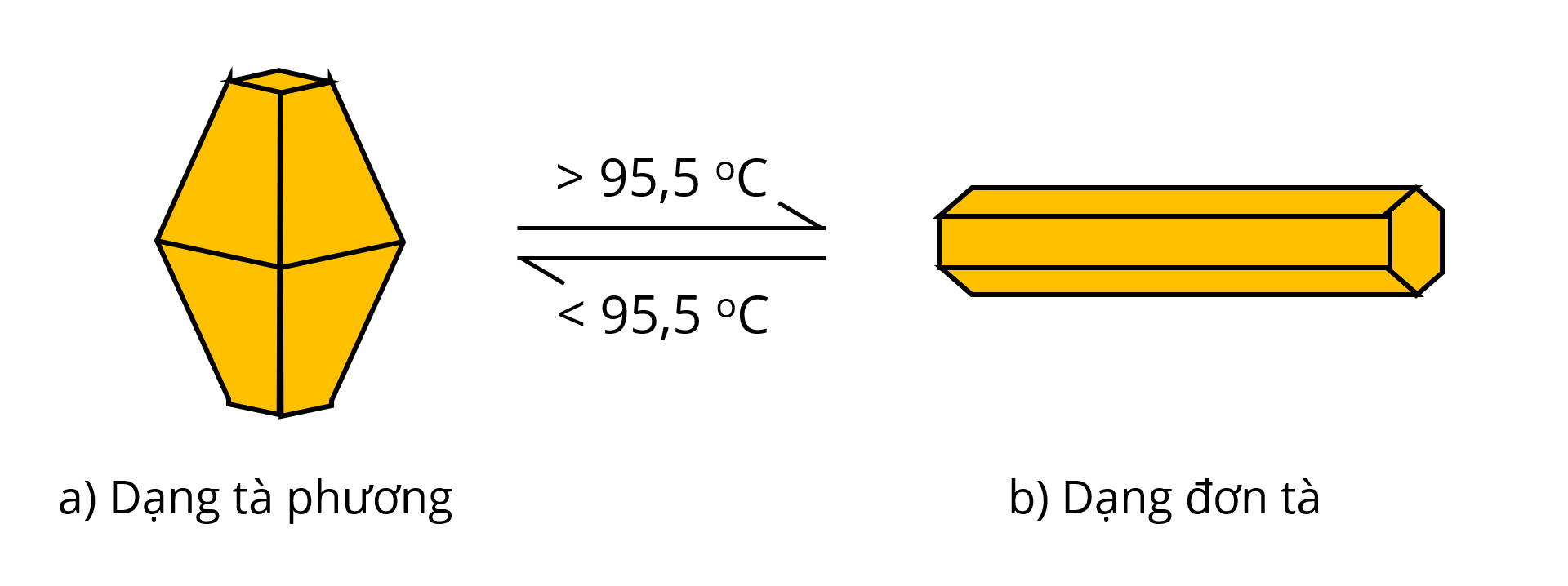
- Sulfur không tan trong nước, ít tan trong alcohol, tan nhiều trong carbon disulfide (CS2).
- tnc = 113oC, ts = 445oC.
Khi tham gia phản ứng hóa học, sulfur có thể thể hiện tính oxi hóa hoặc tính khử. Trong thực tế, hầu hết các phản ứng của sulfur chỉ xảy ra khi đun nóng.
Sulfur thể hiện tính oxi hoá khi phản ứng với hydrogen hoặc kim loại
- Ở nhiệt độ cao, sulfur tác dụng với hydrogen tạo thành hydrogen sulfide:
H2 (g) + S (s) \(\overset{to}{\rightarrow}\) H2S (g) \(\mathrm{\Delta}\)rHo = - 20,6 kJ
- Sulfur tác dụng với thủy ngân (mercury) ngay ở nhiệt độ thường, tác dụng với nhiều kim loại khác ở nhiệt độ cao, tạo thành muối sulfide:
Hg + S \(\rightarrow\) HgS
2Al + 3S \(\overset{to}{\rightarrow}\) Al2S3
Phản ứng của mercury với sulfur được sử dụng để xử lí mercury rơi vãi.
b) Tính khử
Ở nhiệt độ thích hợp, sulfur tác dụng với một số phi kim như fluorine, oxygen,...
3F2 (g) + S(s) \(\rightarrow\) SF6 (g) \(\mathrm{\Delta}\)rHo = - 1220,5 kJ
O2 (g) + S(s) \(\overset{to}{\rightarrow}\) SO2 (g) \(\mathrm{\Delta}\)rHo = - 296,8 kJ
- Chất khí, không màu, mùi hắc, nặng hơn không khí.
- Tan nhiều trong nước (ở 20oC, 1 lít nước hòa tan được 40 lít khí sulfur dioxide).
- Sulfur dioxide là khí độc, hít thở không khí chứa sulfur dioxide vượt ngưỡng cho phép sẽ gây viêm đường hô hấp.
Sulfur dioxide tác dụng với hydrogen sulfide tạo thành sulfur và nước.
SO2 + 2H2S \(\rightarrow\) 3S + 2H2O
Trong thực tiễn, phản ứng trên được dùng để chuyển hóa hydrogen sulfide trong khí thiên nhiên thành sulfur.
Sulfur dioxide tác dụng với nitrogen dioxide (NO2) khi có xúc tác nitrogen oxide để chuyển hóa thành sulfur trioxide.
SO2 + NO2 \(\overset{xúc\ tác}{\rightarrow}\) SO3 + NO
Trong không khí, sulfur dioxide chuyển hóa thành sulfur trioxide, sau đó kết hợp với hơi nước tạo thành sulfuric acid. Đây là phản ứng giải thích quá trình hình thành mưa acid khi không khí bị ô nhiễm bởi sulfur dioxide.
- Sản xuất sulfuric acid.
- Tẩy trắng (bột giấy), khử màu (sản xuất đường), chống nấm mốc,...
- Dung môi
- Tự nhiên: khí thải núi lửa.
- Nhân tạo: quá trình đốt cháy nhiên liệu có chứa tạp chất sulfur (than đá, dầu mỏ,...), đốt quặng sulfide (galen, blend) trong luyện kim, đốt sulfur và quặng pyrite trong sản xuất sulfuric acid.
Sulfur dioxide là một trong các tác nhân làm ô nhiễm khí quyển, gây mưa acid và viêm đường hô hấp ở người.
- Tăng cường sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo.
- Sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên.
- Cải tiến công nghệ sản xuất, có biện pháp xử lí khí thải và tái chế các sản phẩm phụ có chứa sulfur.
1. Nguyên tố sulfur tồn tại trong tự nhiên ở cả dạng đơn chất (mỏ sulfur) và dạng hợp chất (quặng sulfide, sulfate,...)
2. Đơn chất sulfur thể hiện tính oxi hóa (tác dụng với hydrogen, kim loại) và tính khử (tác dụng với oxygen, fluorine,...).
3. Sulfur dioxide vừa có tính oxi hóa vừa có tính khử. Sulfur dioxide là tác nhân gây ô nhiễm không khí, được sinh ra từ núi lửa và các hoạt động của con người.
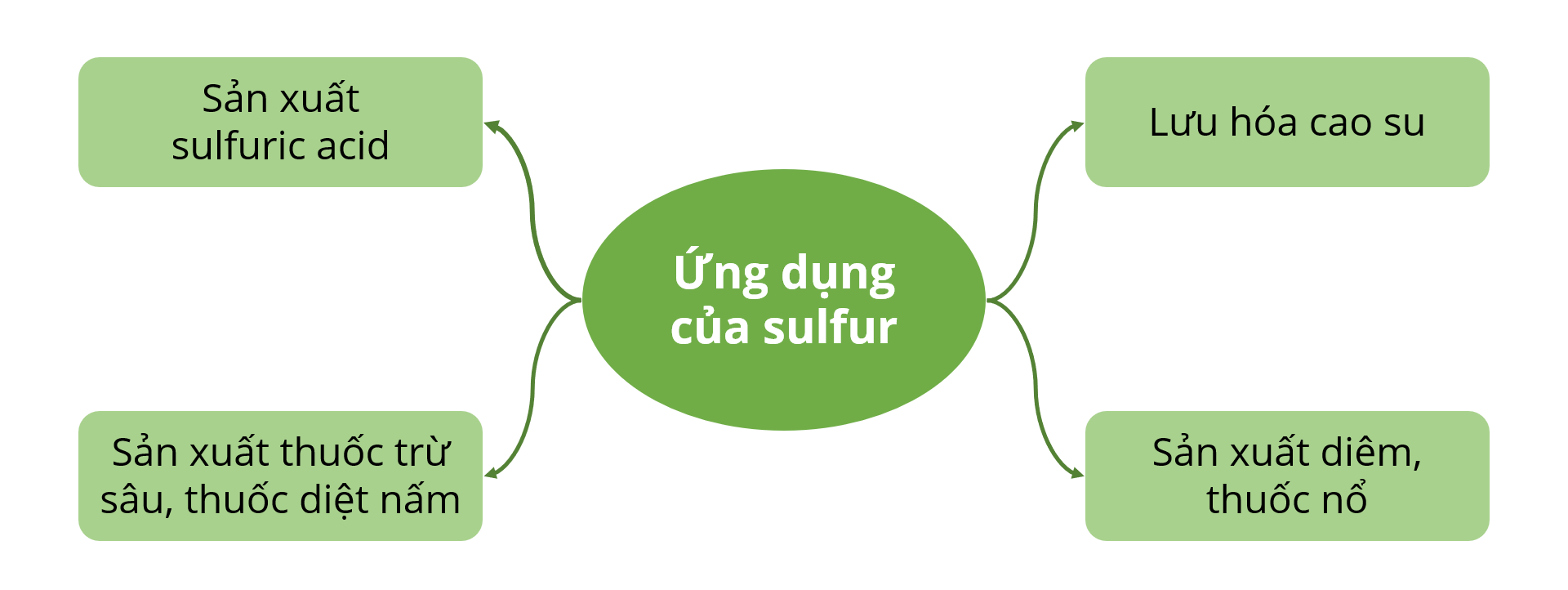
4. Ứng dụng của sulfur: sản xuất sulfuric acid, lưu hóa cao su, sản xuất diêm, thuốc nổ, thuốc trừ sâu, diệt nấm,...