- Hợp chất carbonyl là các hợp chất hữu cơ trong phân tử có chứa nhóm chức carbonyl (C = O). Nhóm chức carbonyl có trong aldehyde, ketone,...
+ Aldehyde là hợp chất hữu cơ có nhóm – CHO liên kết với nguyên tử carbon (trong gốc hydrocarbon hoặc – CHO) hoặc nguyên tử hydrogen.
+ Ketone là hợp chất hữu cơ có nhóm C = O liên kết với hai gốc hydrocarbon.
 |
  |
| Aldehyde | Ketone |
Tên gọi theo danh pháp thay thế của aldehyde đơn chức và ketone đơn chức:
|
Tên aldehyde: Tên hydrocarbon (bỏ e ở cuối) + “al” Ví dụ: CH3 – CH2 – CH = O: propanal |
Tên ketone: Tên hydrocarbon (bỏ e ở cuối) – vị trí nhóm C = O – “one” Ví dụ: CH3 – CO – CH2 – CH2 – CH3: pentan – 2 - one |
Chú ý:
- Mạch carbon là mạch dài nhất chứa nhóm C = O.
- Mạch carbon được đánh số từ nhóm – CHO (đối với aldehyde) hoặc từ phía gần nhóm C = O hơn (đối với ketone).
- Đối với ketone, nếu nhóm C = O chỉ có một vị trí duy nhất thì không cần số chỉ vị trí nhóm C = O.
- Nếu mạch carbon có nhánh thì cần thêm vị trí và tên nhánh ở phía trước.
Một số aldehyde, ketone đơn giản được gọi theo tên thông thường có nguồn gốc lịch sử. Tên thông thường của các aldehyde có nguồn gốc từ tên của acid tương ứng.
Ví dụ:
| HCHO | aldehyde formic (formaldehyde) |
| CH3CHO | aldehyde acetic (acetaldehyde) |
| C6H5CHO | aldehyde benzoic (benzaldehyde) |
| CH3COCH3 | acetone |
- Liên kết đôi C = O phân cực về phía nguyên tử oxygen.
 |
 |
 |
 |
| a) | b) methanal | c) ethanal | d) acetone |
- Các aldehyde, ketone có nhiệt độ sôi cao hơn các hydrocarbon có khối lượng phân tử tương đương do trong phân tử chứa nhóm carbonyl phân cực làm cho phân tử aldehyde, ketone phân cực nên có nhiệt độ sôi cao hơn.
- Ở nhiệt độ thương, các chất aldehyde có phân tử khối nhỏ (methanal, ethanal) ở trạng thái khí, các hợp chất carbonyl thông dụng khác ở trạng thái lỏng.
- Các aldehyde, ketone có mạch carbon ngắn tan tốt trong nước. Khi số nguyên tử carbon tăng thì độ tan của hợp chất carbonyl giảm dần.
| Công thức | Tên | ts (oC) | Độ tan trong nước ở 20oC (g/100 g) | |
| Aldehyde | HCHO | methanal | -21 | tan vô hạn |
| CH3CHO | ethanal | 20 | tan vô hạn | |
| CH3CH2CHO | propanal | 49 | 20 | |
| CH3CH2CH2CHO | butanal | 76 | 7 | |
| Ketone | CH3COCH3 | propanone | 56 | tan vô hạn |
| CH3COCH2CH3 | butanone | 80 | 26 | |
| CH3CH2COCH2CH3 | pentan – 3 – one | 101 | 5 |
Các hợp chất carbonyl bị khử bởi các tác nhân khử như NaBH4, LiAlH4,... (kí hiệu: [H] tạo thành các alcohol tương ứng: aldehyde bị khử tạo thành alcohol bậc I, ketone bị khử tạo thành alcohol bậc II.
Ví dụ:
CH3CH=O + 2[H] → CH3CH2OH
CH3COCH3 + 2[H] → CH3CH(OH)CH3
Aldehyde dễ bị oxy hóa bởi các tác nhân oxi hóa thông thường như: Br2/H2O, [Ag(NH3)2]OH, Cu(OH)2/OH–,...
Aldehyde bị oxi hóa bởi nước bromine tạo thành carboxylic acid.
RCHO + Br2 + H2O → RCOOH + HBr
Ví dụ:
CH3CHO + Br2 + H2O → CH3COOH + 2HBr
- Thuốc thử Tollens là phức chất của ion Ag+ với ammonia, có công thức [Ag(NH3)2]OH. Ion Ag+ trong thuốc thử Tollens đóng vai trò là chất oxi hóa:
RCHO + 2[Ag(NH3)2]OH ![]() RCOONH4 + 2Ag + 3NH3 + H2O
RCOONH4 + 2Ag + 3NH3 + H2O
Ví dụ:
CH3CHO +2[Ag(NH3)2]OH ![]() CH3COONH4 + 2Ag + 3NH3 + H2O
CH3COONH4 + 2Ag + 3NH3 + H2O
- Phản ứng tạo thành lớp bạc sáng bóng bám vào bình phản ứng, vì vậy phản ứng này còn được gọi là phản ứng tráng bạc.
- Ketone không bị oxi hóa bởi thuốc thử Tollens, vì vậy có thể dùng thuốc thử Tollens để phân biệt aldehyde với ketone và các hợp chất khác.
Aldehyde có thể bị oxi hóa bởi copper (II) hydroxide Cu(OH)2 trong môi trường kiềm khi đun nóng tạo thành kết tủa copper (I) oxide (Cu2O) màu đỏ gạch:
RCHO + 2Cu(OH)2 + NaOH ![]() RCOONa + Cu2O + 3H2O
RCOONa + Cu2O + 3H2O
Ví dụ:
CH3CHO + 2Cu(OH)2 + NaOH ![]() CH3COONa + Cu2O + 3H2O
CH3COONa + Cu2O + 3H2O
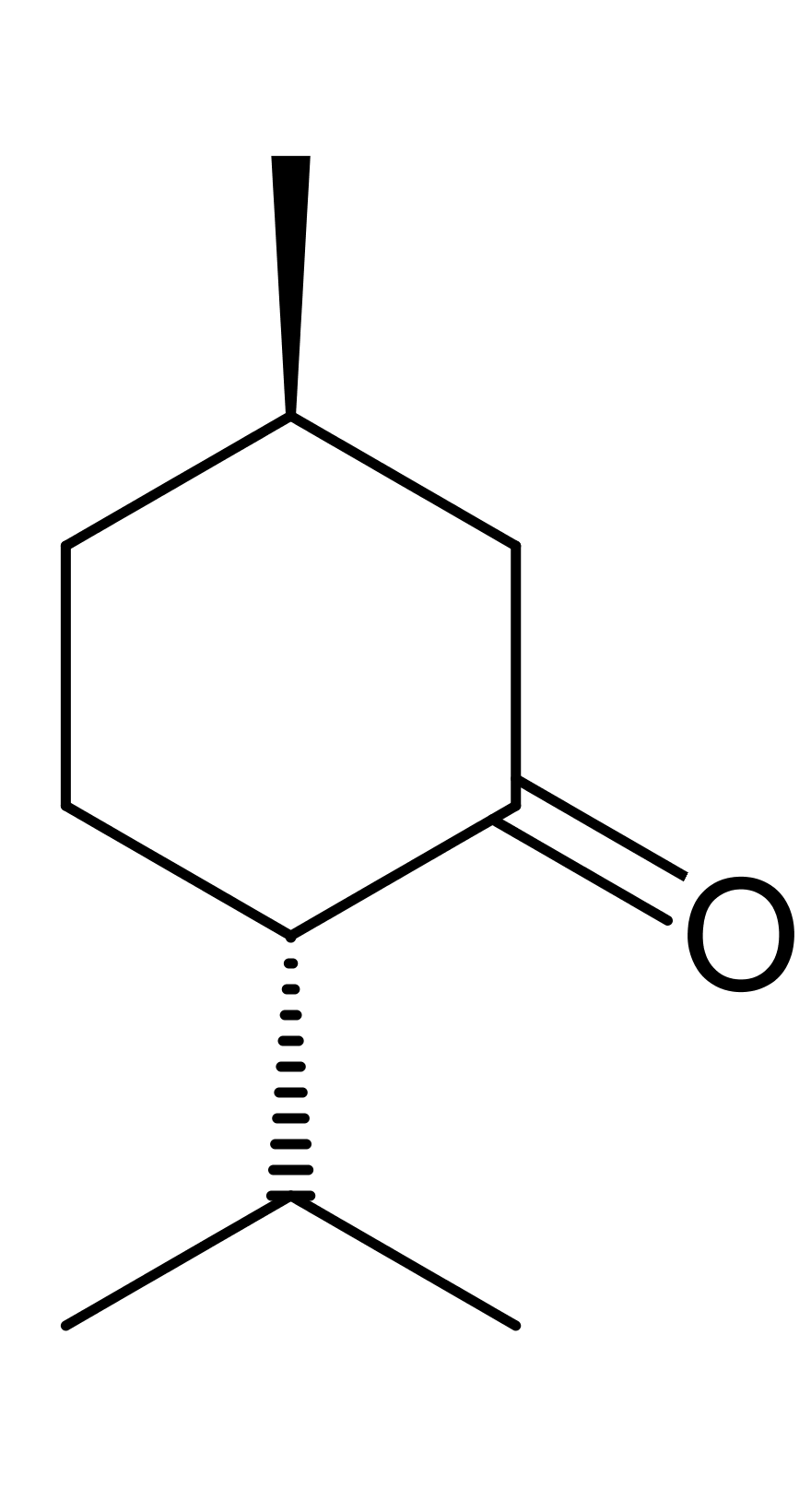
Hợp chất carbonyl có thể tham gia phản ứng cộng với HCN vào liên kết đôi C = O.
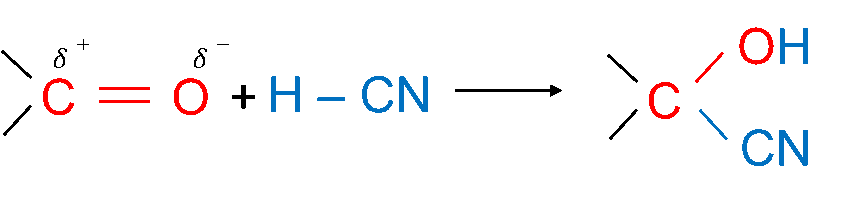
Ví dụ:
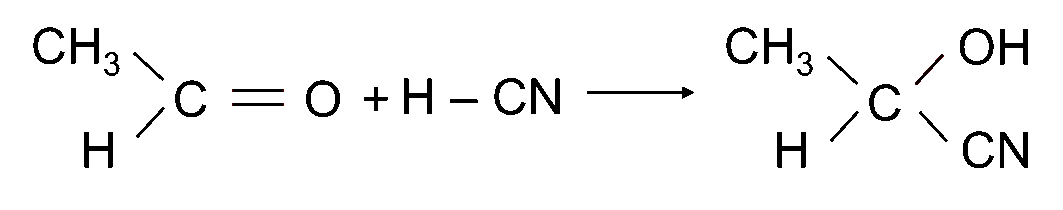 |
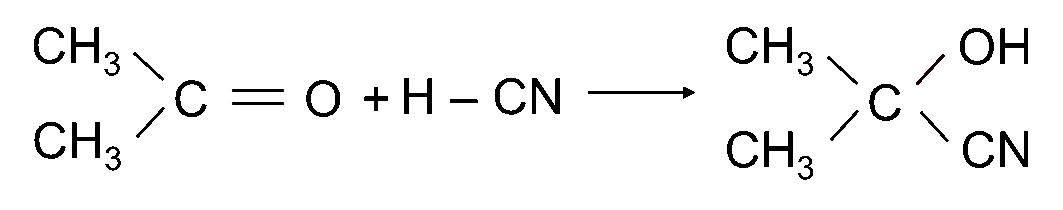 |
Các hợp chất aldehyde, ketone có nhóm methyl cạnh nhóm carbonyl có thể phản ứng với I2 trong môi trường kiềm.
R – CO – CH3 + 3I2 + 4NaOH → R – CO – ONa + CHI3 (iodoform, kết tủa vàng) + 3NaI + 3H2O
Ví dụ:
C2H5 – CO – CH3 + 3I2 + 4NaOH → C2H5 – CO – ONa + CHI3 + 3NaI + 3H2O
CH3 – CHO + 3I2 + 4NaOH → H – CO – ONa + 3NaI + H2O
Phản ứng tạo sản phẩm kết tủa iodoform (CHI3) màu vàng nên phản ứng này được gọi là phản ứng iodoform và được dùng để nhận biết các aldehyde, ketone có nhóm methyl cạnh nhóm carbonyl.
Một số hợp chất carbonyl được tổng hợp trong công nghiệp bằng phương pháp oxi hóa các hydrocarbon, oxi hóa ethylene thành acetaldehyde, oxi hóa cumene thành acetone (quy trình cumene, xem Bài 21. Phenol).
Ví dụ:
| 2CH2 = CH2 + O2 |
|
1. Aldehyde là hợp chất hữu cơ có nhóm – CHO liên kết với nguyên tử carbon (trong gốc hydrocarbon hoặc – CHO) hoặc nguyên tử hydrogen.
Ketone là hợp chất hữu cơ có nhóm C = O kiên kết với hai gốc hydrocarbon.
2. Tên gọi theo danh pháp thay thế:
- Aldehyde đơn chức:
Tên hydrocarbon (bỏ e ở cuối) + “al”
- Ketone đơn chức:
Tên hydrocarbon (bỏ e ở cuối) – vị trí nhóm C = O – “one”
3. Cấu trúc nhóm carbonyl:
4. Các aldehyde, ketone có nhiệt độ sôi cao hơn các hydrocarbon có phân tử khối tương đương. Các aldehyde, ketone có mạch carbon ngắn tan tốt trong nước.
- Phản ứng khử:
Aldehyde + 2[H] → Alcohol bậc I
Ketone + 2[H] → Alcohol bậc II - Phản ứng oxi hóa aldehyde:
Aldehyde \(\underrightarrow{\left[O\right]}\)Carboxylic acid
- Phản ứng cộng:
- Phản ứng tạo iodoform:
R – CO – CH3 + 3I2 + 4NaOH → R – CO – ONa + CHI3 (iodoform, kết tủa vàng) + 3NaI + 3H2O
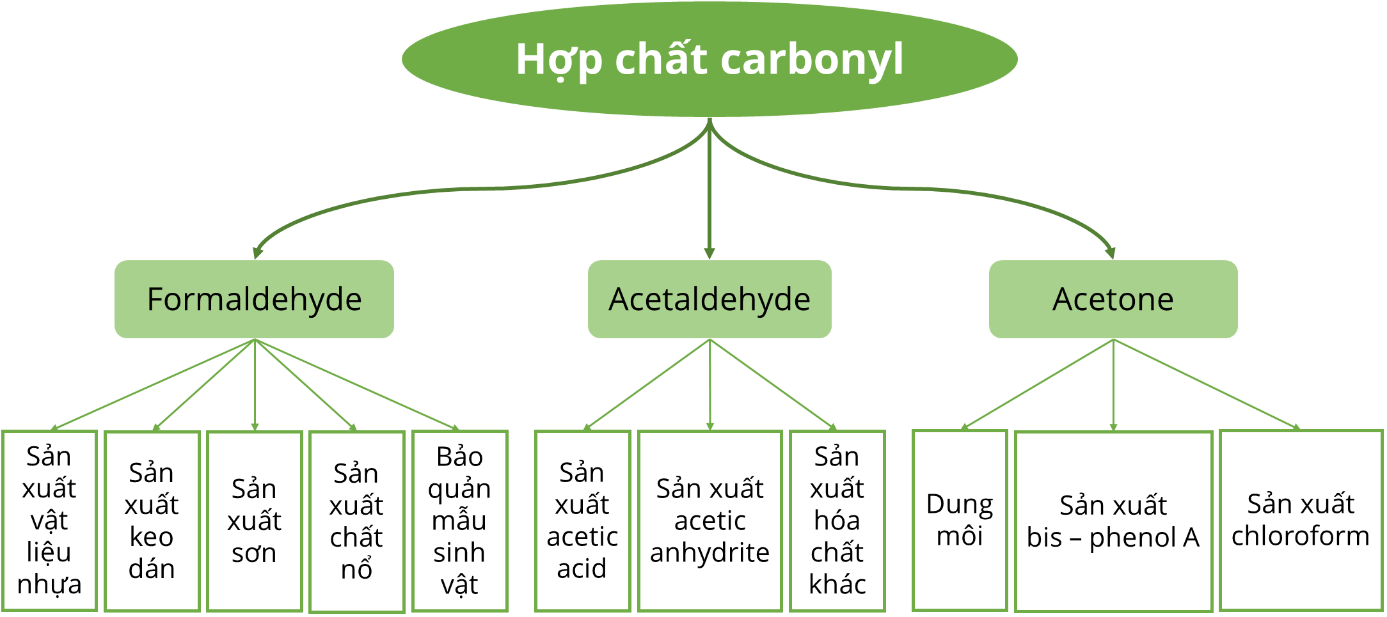
5. Ứng dụng của aldehyde và ketone: formaldehyde dùng để sản xuất vật liệu nhựa, sơn, chất nổ, bảo quản mẫu sinh vật,...; acetaldehyde dùng để sản xuất acetic acid, acetic anhydride,...; acetone dùng làm dung môi, sản xuất chloroform, bisphenol – A,...
6. Điều chế aldehyde và ketone bằng cách oxi hóa hydrocarbon.