- Carboxylic acid là các hợp chất hữu cơ trong phân tử có nhóm – COOH liên kết với nguyên tử carbon (trong gốc hydrocarbon hoặc – COOH) hoặc nguyên tử hydrogen.
- Công thức của các carboxylic acid đơn chức thường được viết ở dạng thu gọn là RCOOH.
- Ví dụ: CH3COOH, CH2 = CHCOOH, C6H5COOH.
- Tên theo danh pháp thay thế của carboxylic acid đơn chức:
Tên hydrocarbon tương ứng (tính cả nhóm – COOH) (bỏ e ở cuối) + “oic acid”
- Ví dụ:
| HCOOH | CH3CH2CH2COOH | CH2 = CHCOOH |
| methanoic acid | butanoic acid | propenoic acid |
Chú ý:
- Mạch chính là mạch carbon dài nhất chứa nhóm – COOH và được đánh số bắt đầu từ nhóm – COOH.
- Nếu mạch carbon có nhánh thì cần thêm vị trí và tên nhánh ở phía trước.
Tên thông thường của carboxylic acid thường xuất phát từ nguồn gốc tìm ra chúng trong tự nhiên.
| Công thức cấu tạo |
Tên theo danh pháp thay thế |
Tên thông thường |
Nguồn gốc |
| HCOOH | methanoic acid | formic acid | Formica: con kiến |
| CH3COOH | ethanoic acid | acetic acid | Acetum: giấm ăn |
| CH3CH2COOH | propanoic acid | propionic acid |
Propion: chất béo đầu tiên |
| CH3[CH2]14COOH | hexandecanoic acid | palmitic acid | Palma: cây cọ |
| CH3[CH2]16COOH | octadecanoic acid | stearic acid |
Stear: chất béo dạng rắn |
| C6H5COOH | phenylmethanoic acid | benzoic acid | Benzoin: tên loại nhựa cây |
| HOOC – COOH | ethanedioic acid | oxalic acid | Oxalis: tên chi thực vật |
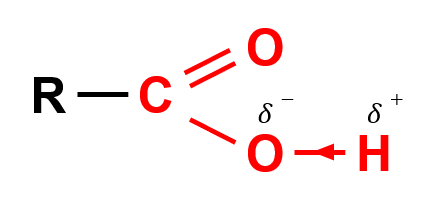
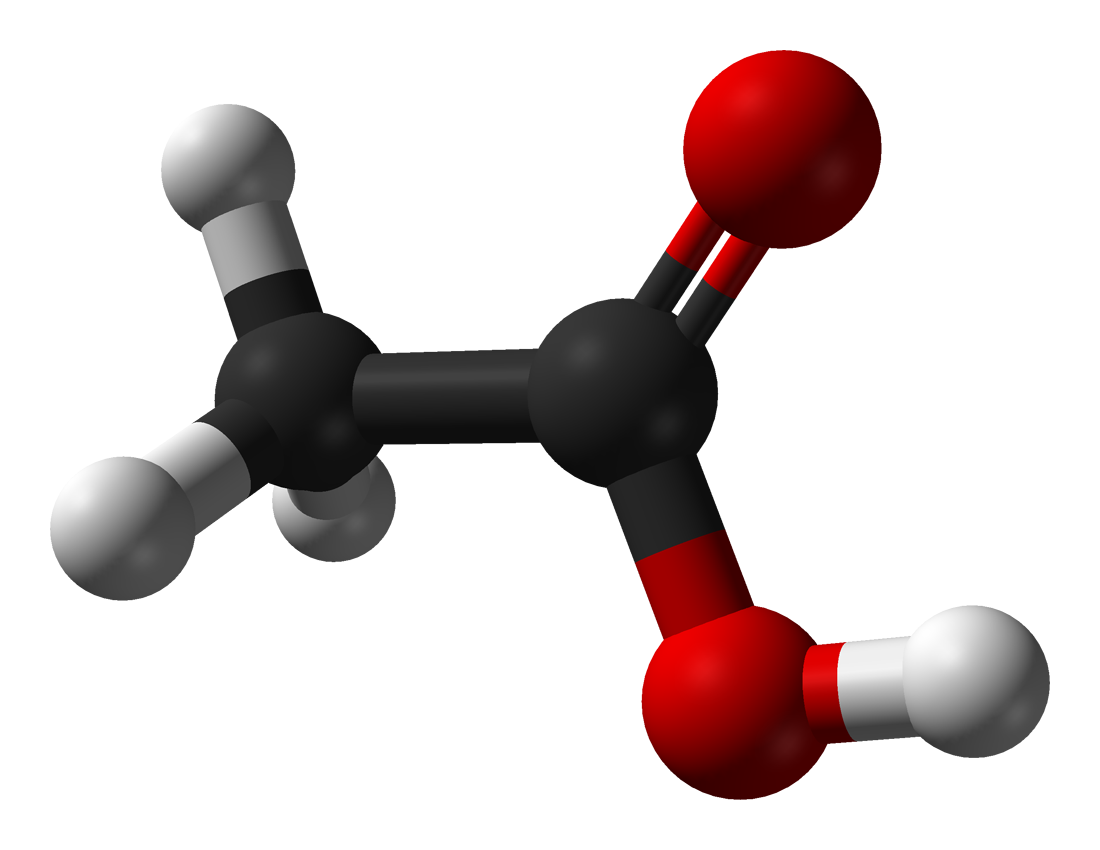
- Nhóm carboxyl gồm có nhóm hydroxy (– OH ) liên kết với nhóm carbonyl (C = O).
- Nhóm C = O là nhóm hút electron nên liên kết O – H trong carboxylic acid phân cực hơn so với alcohol, phenol. Nhóm – COOH có thể phân li ra H+ nên tính chất hóa học đặc trưng của carboxylic acid là tính acid.
 |
 |
| a) | b) |
- Phân tử carboxylic acid chứa nhóm carboxyl phân cực. Các phân tử carboxylic acid liên kết hydrogen với nhau tạo thành dạng dimer hoặc dạng liên phân tử.
|
|
|
| a) | b) |
Do vậy, carboxylic acid có nhiệt độ sôi cao hơn so với hydrocarbon, alcohol, hợp chất carbonyl có phân tử khối tương đương.
- Carboxylic acid mạch ngắn là chất lỏng ở nhiệt độ phòng, carboxylic acid mạch dài là chất rắn dạng sáp. Carboxylic acid thường có mùi chua nồng.
- Carboxylic acid mạch ngắn tan tốt trong nước. Khi tăng số nguyên tử carbon trong gốc hydrocarbon thì độ tan của carboxylic acid giảm.
| Công thức | Tên gọi | Nhiệt độ nóng chảy (oC) | Nhiệt độ sôi (oC) | Độ tan trong nước ở 25oC (g/100 g) |
| HCOOH | methanoic acid | 8 | 101 | tan vô hạn |
| CH3COOH | ethanoic acid | 17 | 118 | tan vô hạn |
| CH3CH2COOH | propanoic acid | - 22 | 141 | tan vô hạn |
| CH3[CH2]2COOH | butanoic acid | - 8 | 164 | tan vô hạn |
| CH3[CH2]3COOH | pentanoic acid | - 34 | 186 | 4,97 |
| CH3[CH2]4COOH | hexanoic acid | - 1,5 | 205 | 1,0 |
| CH3[CH2]8COOH | decanoic acid | 31 | 270 | 0,01 |
Trong dung dịch nước, chỉ cần một phần nhỏ carboxylic acid phân li thành ion, vì vậy carboxylic acid là những acid yếu. Chúng thể hiện đầy đủ tính chất của acid.
Ví dụ:
2CH3COOH + Zn \(\rightarrow\) (CH3COO)2Zn + H2
2CH3COOH + CaCO3 \(\rightarrow \ \)(CH3COO)2Ca + H2O + CO2
2CH3COOH + Ca(OH)2 \(\rightarrow\) (CH3COO)2Ca + 2H2O
2CH3COOH + CuO \(\rightarrow\) (CH3COO)2Cu + H2O
Carboxylic acid phản ứng với alcohol tạo thành ester và nước theo phản ứng:
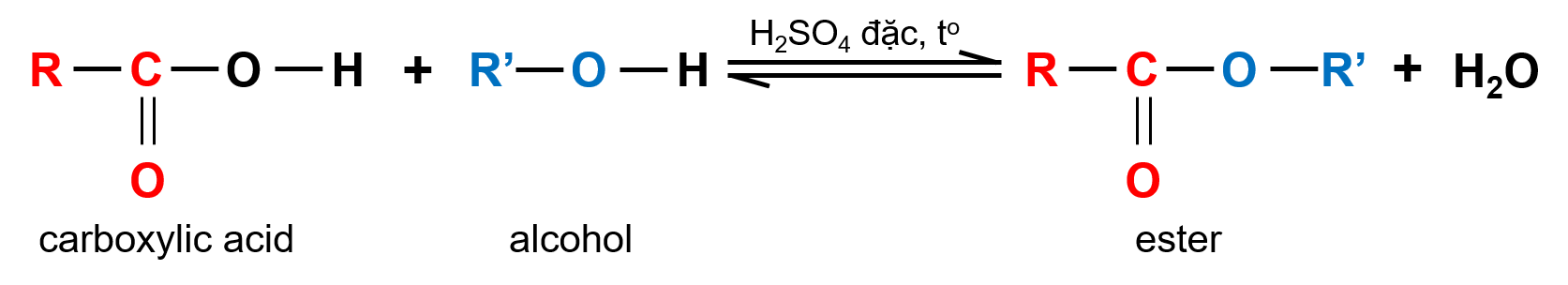
Phản ứng giữa carboxylic acid và alcohol được gọi là phản ứng ester hóa. Phản ứng có đặc điểm thuận nghịch và thường dùng sulfuric acid đặc làm xúc tác.
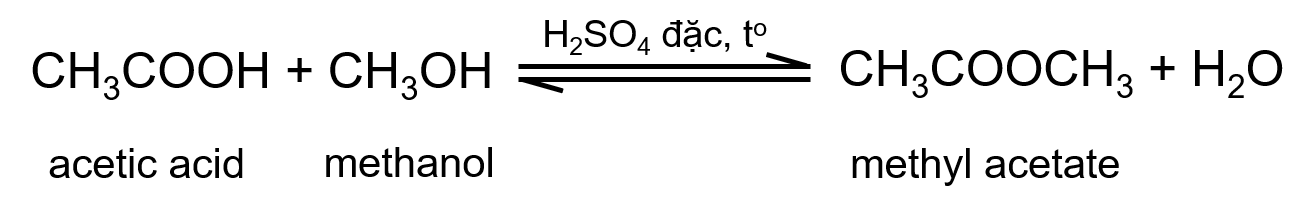
Ví dụ:
Phương pháp lên men được sử dụng từ thời xa xưa để làm giấm. Nguyên liệu thường là các loại rượu như rượu gạo, rượu tao, rượu vang,... Quá trình lên men nhờ vi khuẩn acetobacter (men giấm) chuyển hóa ethanol thành acetic acid bởi oxygen không khí.
C2H5OH + O2 \(\overset{men\ giấm}{\rightarrow}\) CH3COOH + H2O
Trong công nghiệp, người ta cung cấp thêm oxygen để tăng tốc độ phản ứng lên men.
Các alkene bị oxi hóa cắt mạch tạo thành các acid:
R – CH2 – CH2 – R’ \(\overset{\lbrack O\rbrack}{\rightarrow}\) RCOOH + R’COOH
Ví dụ:
2CH3CH2CH2CH3 + 5O2 \(\underrightarrow{xt,p,t^o}\) 4CH3COOH + 2H2O
.png)
1. Carboxylic acid là các hợp chất hữu cơ trong phân tử có nhóm – COOH liên kết với nguyên tử carbon (trong gốc hydrocarbon hoặc – COOH) hoặc nguyên tử hydrogen.
Có thể biều diễn công thức của carboxylic acid đơn chức dưới dạng: RCOOH.
2. Danh pháp thay thế của carboxylic acid đơn chức:
Tên hydrocarbon tương ứng (tính cả nhóm – COOH) (bỏ e ở cuối) + “oic acid”
3. Nhóm – COOH có liên kết O – H phân cực.
Nhóm – COOH có thể phân li thành H+ nên tính chất hóa học đặc trưng của carboxylic acid là tính acid.
4. Carboxylic mạch ngắn là chất lỏng, tan tốt trong nước. Carboxylic acid mạch dài là chất rắn và ít tan trong nước.
5. Phản ứng ester hóa:
6. Điều chế:
- Phương pháp lên men giấm:
C2H5OH + O2 \(\overset{men\ giấm}{\rightarrow}\) CH3COOH + H2O
- Phương pháp oxi hóa alkane:
R – CH2 – CH2 – R’ \(\overset{\lbrack O\rbrack}{\rightarrow}\) RCOOH + R’COOH
7. Ứng dụng: vật liệu sản xuất polymer, dược phẩm, dung môi, thương hiệu, phụ gia thực phẩm, chất tẩy rửa.