 Hoá học 11 (Kết nối tri thức với cuộc sống)
Bài 17: Arene (Hydrocarbon thơm)Arene (hydrocarbon thơm)
Hoá học 11 (Kết nối tri thức với cuộc sống)
Bài 17: Arene (Hydrocarbon thơm)Arene (hydrocarbon thơm)- Arene hay còn gọi là hydrocarbon thơm là những hydrocarbon trong phân tử có chứa một hay nhiều vòng benzene.
- Benzene có công thức C6H6 là một hydrocarbon thơm đơn giản và điển hình nhất.
- Benzene và các đồng đẳng của nó hợp thành dãy đồng đẳng của benzene có công thức chung là CnH2n-6 (n \(\geq\) 6).
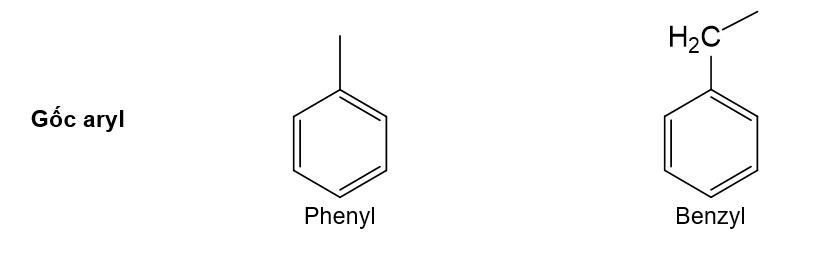
Một số arene, gốc aryl thường gặp có công thức cấu tạo và tên gọi như sau:
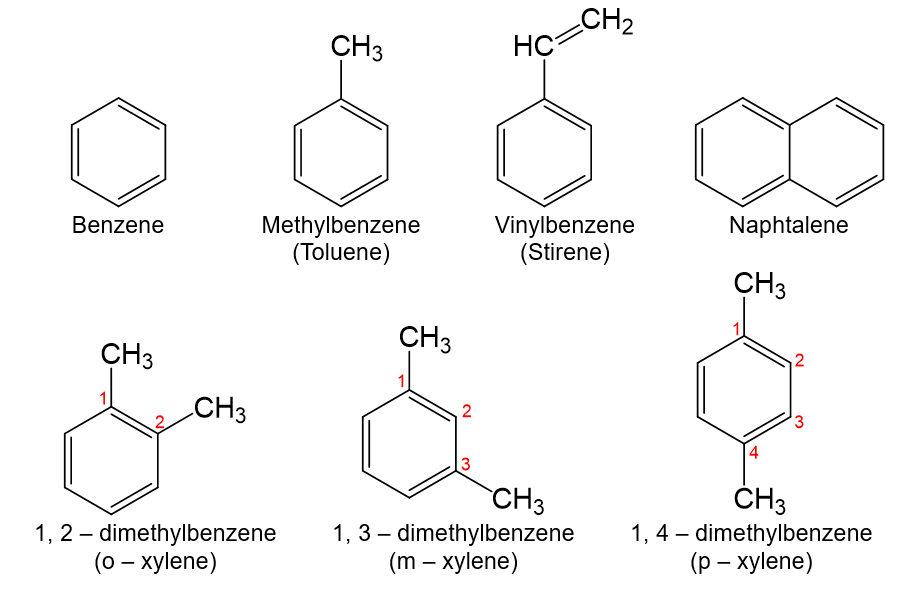
(o-; m-; p- là viết tắt của các từ tương ứng ortho-; metha-; para- chỉ vị trí 2, 3, 4 của nhóm thế thứ hai).
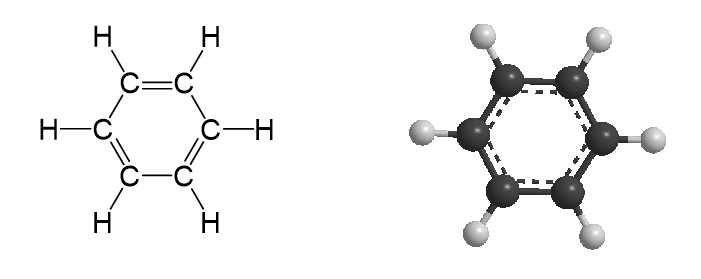
- Phân tử benzene có 6 nguyên tử carbon tạo thành hình lục giác đều, tất cả nguyên tử carbon và hydrogen đều nằm trên một mặt phẳng, các góc liên kết đều bằng 120\({^\circ},\) độ dài liên kết carbon – carbon đều bằng 139 pm.
- Để đơn giản, benzene thường được biểu diễn bởi các kiểu công thức dưới đây:
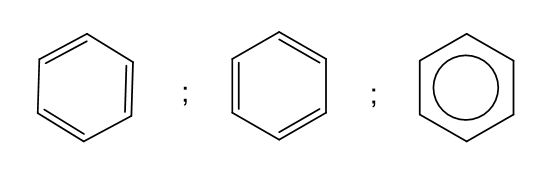
- Benzene, toluene, xylene, styrene ở điều kiện thường là chất lỏng không màu, trong suốt, dễ cháy và có mùi đặc trưng. Naphthalene là chất rắn màu trắng, có mùi đặc trưng (có thể phát hiện được ở nồng độ thấp).
- Các arene không phân cực hoặc kém phân cực nên không tan trong nước và thường nhẹ hơn nước, tan được trong các dung môi hữu cơ.
| Arene | tnc (oC) | ts (oC) | Khối lượng riêng (g/cm3) |
| Benzene | 5,5 | 80,1 | 0,878 |
| Toluene | -95,0 | 110,6 | 0,867 |
| o- Xylene | -25,2 | 144 | 0,880 |
| m- Xylene | -47,4 | 139 | 0,864 |
| p- Xylene | 13,3 | 138 | 0,861 |
| Styrene | -30,0 | 145 | 0,909 |
| Naphthalene | 80,26 | 218 |
1,0253 (20 oC) 0,9625 (100 oC) |
- Benzene, toluene, xylene (được gọi chung là BTX) có trong dầu mỏ với hàm lượng thấp. Khi chưng cất dầu thô thường nhận được phân đoạn có chứa các arene này, Naphthalene và các arene đa vòng khác có trong dầu mỏ và nhựa than đá.
- Arene có thể tham gia phản ứng thế nguyên tử hydrogen ở vòng benzene như phản ứng halogen hóa, nitro hóa,...
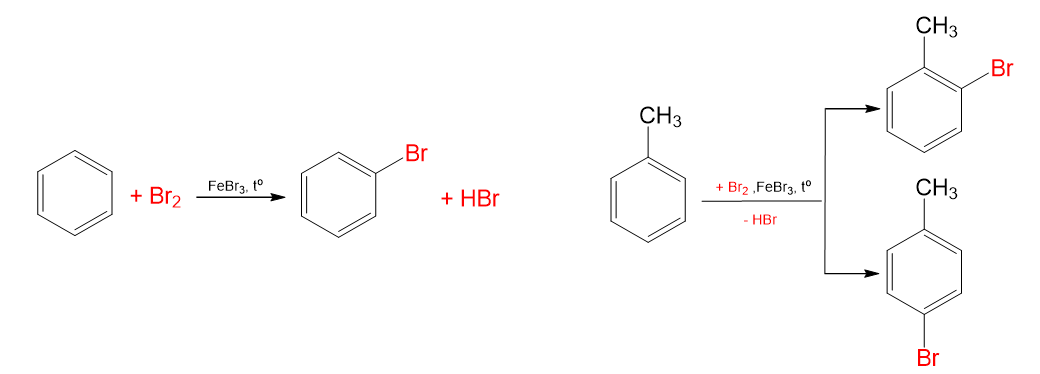
- Quy tắc thế: Khi benzene có nhóm thế alkyl (-CH3, -C2H5,...), các phản ứng thế nguyên tử hydrogen ở vòng benzene xảy ra dễ dàng hơn so với benzene và ưu tiên thế vào vị trí số 2 hoặc số 4 (vị trí ortho hoặc para) so với nhóm alkyl.
- Các arene tham gia phản ứng thế nguyên tử hydrogen gắn với vòng thơm bằng halogen (chlorine, bromine) ở nhiệt độ cao khi có xúc tác muối iron(III) halide.
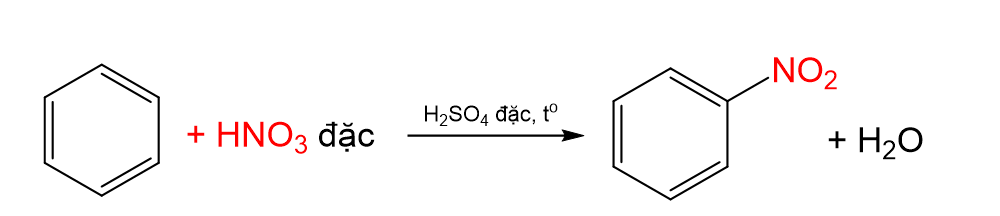
- Phản ứng nitro hóa là phản ứng trong đó một hay nhiều nguyên tử hydrogen ở vòng benzene được thay thế bằng nhóm nitro (- NO2).
- Benzene được nitro hóa bằng hỗn hợp HNO3 đặc và H2SO4 đặc ở nhiệt độ không quá 50oC tạo nitrobenzene dạng lỏng, màu vàng nhạt, sánh như dầu:
- Toluene được nitro hóa tạo thành hỗn hợp hai sản phảm chính là ortho và para – nitrotoluene.
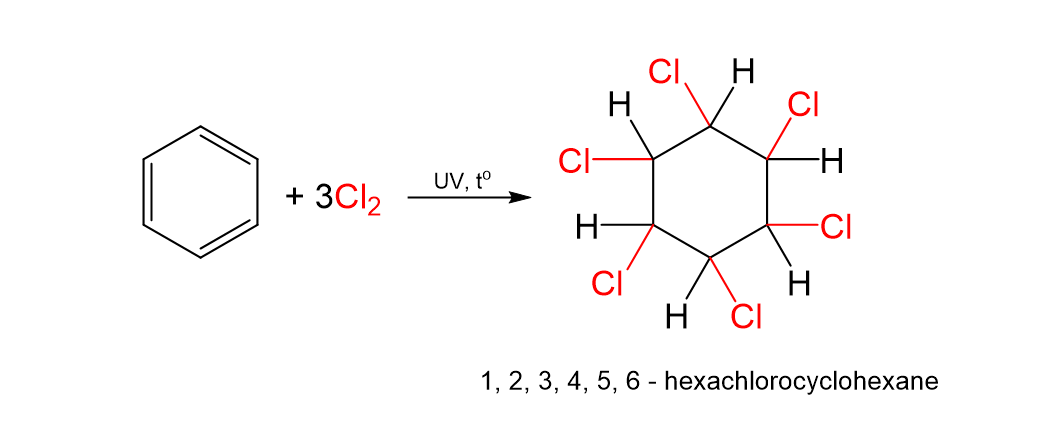
Phản ứng cộng chlorine và benzene trong điều kiện có ánh sáng tử ngoại và đun nóng, sản phẩm thu được là 1,2,3,4,5,6 – hexachlorocyclohexane.
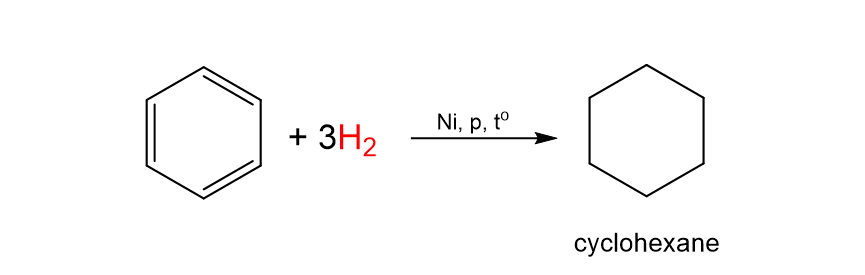
Phản ứng cộng hydrogen vào benzene tạo thành cyclohexane. Phản ứng xảy ra ở điều kiện áp suất cao và nhiệt độ cao, với sự có mặt của các chất xúc tác dị thể như platinum, nickel.
Các arene như benzene, toluene, xylene dễ cháy và tỏa nhiều nhiệt.
C6H5CH3 + 9O2 \(\overset{t{^\circ}}{\rightarrow}\) 7CO2 + 4H2O
Toluene và các alkylbenzene khác có thể bị oxi hóa bởi các tác nhân oxi hóa như dung dịch KmnO4.
Ví dụ:
C6H5CH3 + 2KMnO4 \(\overset{t{^\circ}}{\rightarrow}\) C6H5COOK + 2MnO2 + KOH + H2O
C6H5COOK + HCl \(\rightarrow\) C6H5COOH + KCl
.png)
Cách ứng xử thích hợp với việc sử dụng arene
- Arene (chủ yếu là benzene, toluene và xylene) là nguồn nguyên liệu để tổng hợp nhiều loại hóa chất và vật liệu hữu cơ quan trọng, có nhiều ứng dụng trong đời sống.
- Tuy nhiên, arene là những chất độc nên khi làm việc với arene cần tuân thủ đúng quy tắc an toàn. Benzene là chất làm tăng nguy cơ gây ung thư và các bệnh khác, vì vậy không được tiếp xúc trực tiếp với hóa chất này.
- Đặc biệt, các thuốc bảo vệ thực vật (thuốc trừ sâu, trừ cỏ) thế hệ cũ là dẫn xuất của benzene đều có tác hại đối với sức khỏe con người và gây ô nhiễm môi trường, do vậy cần hết sức thận trọng khi sử dụng. Không được sử dụng các chất đã bị cấm như DDT (dichlorodiphenyltrichloroethane) hay 666 (1, 2, 3, 4, 5, 6 – hexachlorocyclohexane), thay vào đó là những thuốc thế hệ mới vừa hiệu quả vừa an toàn.
- Ngày nay, các nhà khoa học nghiên cứu và đưa ra công nghệ tổng hợp hữu cơ an toàn, thân thiện môi trường và hướng đến các nguồn nguyên liệu nguồn gốc thiên nhiên.
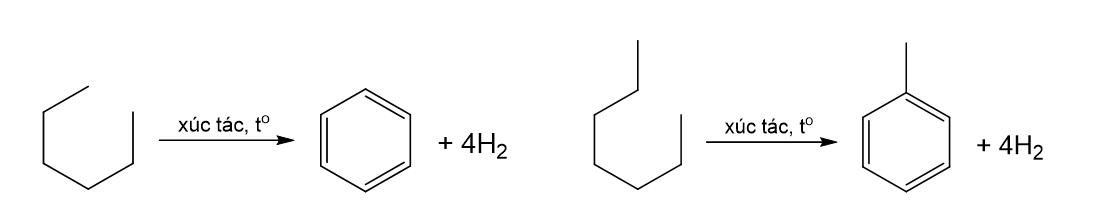
- Trong công nghiệp, benzene, toluene được điều chế từ quá trình reforming phân đoạn dầu mỏ chứa các alkane và cycloalkane C6 – C8.
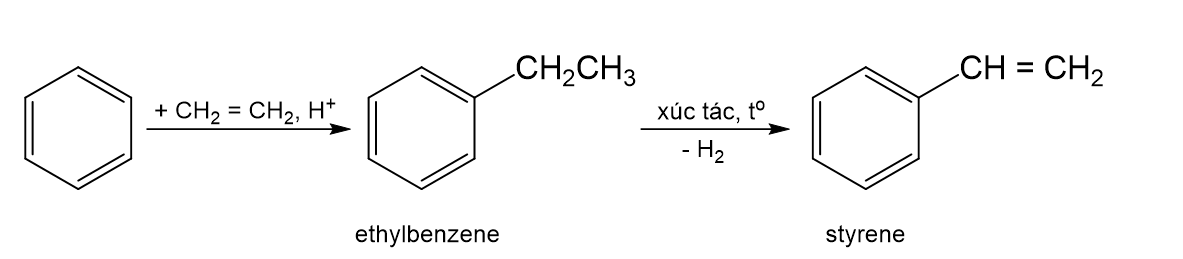
- Ethylbenzene được điều chế từ phản ứng giữa benzene và ethylene với xúc tác acid rắn là zeolite.
- Naphthalene được điều chế chủ yếu bằng phương pháp chưng cất nhựa than đá.
1. Arene là những hydrocarbon trong phân tử có chứa một hay nhiều vòng benzene.
2. Benzene, toluene, xylene, styrene ở điều kiện thường là chất lỏng không màu, trong suốt, dễ cháy và có mùi đặc trưng. Naphthalene là chất rắn kết tinh màu trắng, có mùi đặc trưng. Các arene không tan trong nước và thường nhẹ hơn nước, tan trong các dung môi hữu cơ.
3. Phản ứng thế vào vòng thơm benzene
a) Halogen hóa
C6H6 + Br2 \(\underrightarrow{FeBr_3,t^o}\) C6H5Br + HBr
CH3C6H5 + Br2 \(\underrightarrow{FeBr_3,t^o}\) o-, p- CH3C6H4Br + HBr
b) Nitro hóa
C6H6 \(\underrightarrow{+HNO_3đ,H_2SO_4đ,t^o}\) C6H5NO2 + H2O
CH3C6H5 \(\underrightarrow{+HNO_3đ,H_2SO_4đ,t^o}\) o-, p- CH3C6H4NO2 + H2O
4. Phản ứng cộng
a) Cộng chlorine
C6H6 \(\underrightarrow{+Cl_2,UV,t^o}\)C6H6Cl6
b) Cộng hydrogen
C6H6 \(\underrightarrow{+H_2,p,Ni,t^o}\) C6H12
5. Phản ứng oxi hóa
a) Phản ứng cháy
Các arene dễ cháy và tỏa nhiều nhiệt
b) Phản ứng oxi hóa nhóm alkyl
6. Ứng dụng của arene: nguyên liệu đầu để tổng hợp polymer, dung môi, thuốc nhuộm, dược phẩm, chất dẻo, tơ sợi tổng hợp,...
Arene có độc tính, cần được sử dụng một cách hợp lí: hạn chế sử dụng thuốc bảo vệ thực vật và chỉ sử dụng thuốc thế hệ mới.
7. Điều chế
a) Dầu mỏ \(\overset{chưng\ cất\ phân\ đoạn}{\rightarrow}\) alkane và cycloalkane C6 – C8 \(\overset{reforming}{\rightarrow}\) benzene,toluene,xylene.
b) Benzene \(\overset{+ \ ethylene}{\rightarrow}\) ethylbenzene \(\overset{- \ H_{2}}{\rightarrow}\) styrene
c) Nhựa than đá \(\overset{chưng\ cất}{\rightarrow}\) naphthalene